- Mensajes: 34
- Gracias recibidas: 13
- Foro
- Foro Principal
- Casos clínicos
- Postrema area syndrome secondary to systemic lupus erythematosus: case report and literature review
Postrema area syndrome secondary to systemic lupus erythematosus: case report and literature review
- Webmaster
- [Webmaster]
-
 Autor del tema
Autor del tema
- Fuera de línea
- Administrador
-

Menos
Más
2 años 10 meses antes #59
por Webmaster
Postrema area syndrome secondary to systemic lupus erythematosus: case report and literature review Publicado por Webmaster
Autores:
Muñoz-Zuñiga Jose Ricardo1, Tamayo-Delgado Andrea del Mar2, Shinchi-Tanaka Alberto Masaru 3, Márquez Juan Camilo 4 Echeverry-García Alex 5,6
(1) Residente de Neurología; Universidad Icesi, Cali, Colombia;
(2) Residente de Radiología e imágenes diagnósticas; Universidad Icesi, Cali, Colombia;
(3) Servicio de Neurología, Fundación Valle del Lili, Cali, Colombia
(4) Servicio de Radiología, Fundación Valle del Lili, Cali, Colombia;
(5) Servicio de Reumatología y enfermedades autoinmunes sistémicas, Fundación Valle del Lili, Cali, Colombia;
(6) Centro de investigación en reumatología, autoinmunidad y medicina traslacional, Universidad Icesi.
Autor de correspondenciar:
Jose Ricardo Muñoz Zuñiga
Email: Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
Abstract:
Postrema area syndrome (PAS) is commonly associated with neuromyelitis optic spectrum disorders (NMOSD). We present a case of a 27-year-old woman, with a history of systemic lupus erythematosus (SLE) with multiple manifestations, that developed incoercible emesis associated with abdominal pain and a single episode of altered consciousness. During her work up magnetic resonance imaging showed a punctiform hyperintensity in the postrema area without other findings in the neuroaxis. Her anti-aquaporin 4 antibodies were negative. It was considered a diagnosis of PAS secondary to SLE relapse. This association is infrequent and there is little bibliography so it could represent a diagnostic challenge.
Key words: Area Postrema, Systemic Lupus Erythematosus, Vomit
Resumen:
El síndrome del área postrema (SAP) está asociado con los trastornos del espectro de neuromielitis óptica principalmente (TENMO). Presentamos un caso de una mujer de 27 años, con antecedente de Lupus eritematoso sistémico (LES), con compromiso multisistémico que consultó por cuadro de emesis incoercible asociado a dolor abdominal y un único episodio de alteración de la consciencia. Durante sus estudios complementarios la imagen de resonancia magnética mostró una hiperintensidad puntiforme en el área postrema sin otros hallazgos en el neuroeje. Sus anticuerpos anti-acuaporina 4 fueron negativos. Se consideró diagnóstico de SAP secundario a una recaída de LES. Esta asociación es infrecuente y hay poca bibliografía al respecto, por lo que puede representar un reto diagnóstico.
Palabras clave: Área Postrema, Lupus Eritematoso Sistémico, Vómito.
Introducción:
Las náuseas y vómito son causados por múltiples etiologías. Neurobiológicamente, están controlados por varias estructuras centrales ubicadas en el tronco encefálico. Una de estas estructuras es el área postrema (AP), que sirve como la zona quimiorreceptora que desencadena emesis (1).
La AP fue descrita por primera vez en 1896 por el neuroanatomista sueco Magnus Gustaf Retzius en su libro "El cerebro humano. Estudios de morfología macroscópica" (2) de la siguiente manera: "estructura esponjosa localizada en el tronco encefálico, cerca del agujero de Magendie". Pero no fue hasta principios del siglo pasado (1920) cuando se determinaron la estructura y la función (1). Se localiza en el rombencéfalo, situada en el cuarto ventrículo, en la superficie dorsal de la médula adyacente al núcleo del tracto solitario. Es un verdadero núcleo del bulbo, forma parte de los órganos circumventriculares, carece de barrera hematoencefálica y consiste en una red vascular densa y ramificada con sinusoides vasculares, fenestras múltiples y ausencia de uniones estrechas. Estas características le permiten detectar elementos en la sangre y el líquido cefalorraquídeo, funcionando como un regulador osmótico e inmunomodulador. Además, funciona como un quimiorreceptor que media el hipo y la emesis (3) (4).
El daño en esta ubicación configura el síndrome del área postrema (SAP), que se define como ataques incoercibles de náuseas, vómitos o hipo en el contexto de una lesión dorsal en el tronco encefálico. Los trastornos del espectro de neuromielitis óptica (TENMO) generalmente se considera como la primera etiología, ya que el daño a este objetivo es parte de los criterios diagnósticos para estos diagnósticos (4). Sin embargo, la asociación con otras enfermedades autoinmunes es rara. Presentamos el caso de un paciente con antecedentes de LES que, en el contexto de una recidiva de la enfermedad, desarrolló un SAP de probable origen inflamatorio como manifestación atípica, y revisamos la literatura disponible sobre el tema.
Caso clínico:
Paciente del sexo femenino de 27 años ingresada en nuestra institución por un cuadro clínico de 10 días de evolución consistente en episodios repetidos de emesis, de contenido alimenticio y bilioso, asociado a dolor localizado en el epigastrio y disfagia para alimentos sólidos y líquidos. Tenía antecedentes de LES, con afectación en múltiples sistemas (Osteoarticular, hematológico, renal e inmunológico), con controles médicos regulares en los últimos meses y estaba siendo tratada con azatioprina 50 mg cada 12 horas, cloroquina 250 mg cada 24 horas y losartan 50 mg cada 24 horas. En el examen físico tenía signos de deshidratación leve y sin signos peritoneales irritativos. Los laboratorios iniciales mostraron lipasa sérica y amilasa elevados, fragmento del complemento C3 consumido y anticuerpo antiADN elevado (ver Tabla 1 para valores y referencias). Los estudios de imagen consistieron en tomografía abdominal contrastada, ecografía abdominal y endoscopia, todas negativas. Dada la persistencia de los síntomas, se realizó un diagnóstico de pancreatitis aguda leve con LES recidivante y se proporcionó tratamiento intrahospitalario sintomático, sin mejoría.
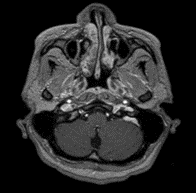
Debido a la evolución tórpida de la paciente, su familia fue interrogada sobre el estado de la paciente, a lo que el familiar agregó síntomas adicionales consistentes en episodios de accesos de tos con posterior alteración de la conciencia y movimientos anormales en las extremidades compatibles con crisis epiléptica tónica clónica bilateral con amnesia del evento. Se sospechó una etiología en el sistema nervioso central por lo que, posteriormente, se solicitó una resonancia magnética contrastada del cerebro; esta reportó una lesión única hiperintensa en la secuencia T2 en el área postrema; por lo tanto, se enfocó como un posible SAP (Imagen 1). Para descartar posibles etiologías se realizó una punción lumbar que informó presión de apertura de 26 cmH2O, 1 linfocito, glucosa 56mg/dL, proteínas 26 mg/dL; Gram/Tinta china/Panel molecular para meningitis fueron negativos. Además, los cultivos para bacterias, hongos, micobacterias, PCR-RT para tuberculosis y bandas oligoclonales fueron todos negativos. Dado lo anterior, se decidió cambiar el esteroide de prednisolona a hidrocortisona 100 mg cada 8 horas. La paciente mejoró significativamente después de este ajuste hasta el punto en que sus síntomas cesaron, y pudo ser dada de alta con una fórmula médica.
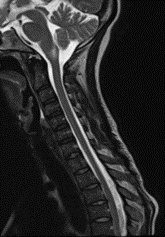
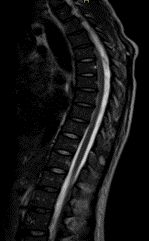
Una semana más reingresó a por servicio de urgencias debido a una exacerbación aguda del dolor abdominal previo y emesis. Se realizaron nuevos estudios de imagen complementarios: la colangiopancreatografía por resonancia magnética fue negativa, descartando enfermedades de la vesícula biliar y una nueva resonancia magnética contrastada del cerebro y la columna cérvico- descartó mielopatía en la columna vertebral, pero mostró un aumento considerable en la extensión del área de la lesión postrema con un notorio realce con gadolinio (Imagen 2). Se indicó un pulso de metilprednisolona de 1 gramo durante 3 días, se realizó una reinducción de ciclofosfamida; recibió un total de 2 dosis durante su hospitalización. Fue dada de alta nuevamente con mejoría clínica con una orden de continuar con ciclofosfamida, medicación previa y una orden para un perfil complementario de síndrome de antifosfolípidos y anticuerpos anti-acuaporina 4. En un control ambulatorio posterior, el paciente no refirió nuevas recaídas y mostró una IgM anticardiolipina positiva e IgM positiva para la glicoproteína beta 2 I con anticuerpos anti-acuaporina 4 negativos. Se añadió una dosis baja de inhibidores de la agregación plaquetaria y se realizó un diagnóstico altamente probable de SAF secundario a LES.
Discusión:
El LES es una enfermedad autoinmune que puede comprometer cualquier órgano. El compromiso neurológico es una de las principales causas de morbilidad y mortalidad en estos pacientes (5). El término LES neuropsiquiátrico (LESNP) es un término genérico que se refiere a varios síntomas neurológicos y psiquiátricos directamente relacionados con el LES. En aproximadamente el 30% de los pacientes con síntomas neuropsiquiátricos, el lupus es la causa principal y los síntomas se manifiestan con mayor frecuencia alrededor del inicio de la enfermedad. Las afecciones neurovasculares y psicóticas también pueden conducir a LESNP (10).
Dentro del espectro clínico del LES, la afectación del sistema nervioso representa el mayor reto diagnóstico y terapéutico, ya que engloba una numerosa variedad de manifestaciones neurológicas que varían en su presentación desde focales a difusas, centrales, periféricas, aisladas, complejas, leves o severe y que pueden ocurrir en cualquier momento de la enfermedad (5).
La prevalencia del LESNP es del 12 al 95% de los cuales tienen una afectación del sistema nervioso central del 93,1-95% (4,5) y el síndrome desmielinizante ocurre entre el 0,9 y el 2,7% de los casos (4). En Colombia, las manifestaciones más frecuentes de LESNP son cefalea (13,1%) y enfermedad cerebrovascular (8%); solo 0,4% presentó síndrome desmielinizante, por lo que incluso para los estándares nacionales es una presentación muy rara. Según el conocimiento de los autores, este sería el tercer caso de SAP secundario al LES (7).
Fisiopatológicamente, se considera que estas manifestaciones están mediadas por una combinación no exclusiva de lesión isquémica e inflamación. En el primer caso, la acción de los antifosfolípidos anticuerpos, los complejos inmunes y la activación del complemento podrían causar eventos focales con manifestaciones neuropsiquiátricas difusas. En el segundo caso, participa el aumento de la permeabilidad de la barrera hematoencefálica, la unión de autoanticuerpos a las neuronas, la formación intratecal de complejos inmunes y la producción de mediadores inflamatorios (5)(6).
El principal diagnóstico diferencial es TENMO (4). Vale la pena mencionar que las lesiones del área postrema no son específicas de estos trastornos (4); hay evidencia de coexistencia con enfermedades autoinmunes seropositivas como artritis reumatoide, sarcoidosis, síndrome de Sjögren y LES (6). Este espectro de trastornos presenta afectación variada del sistema nervioso central (nervios ópticos, médula espinal, diencéfalo, tronco encefálico y lluvia). La alta especificidad de AQP4-IgG ha permitido el reconocimiento de un espectro más amplio de características clínicas y radiológicas relacionadas con TENMO (4). Se ha demostrado la positividad de anticuerpos anti-AQP4 positivos en el LES ( , lo que asocia esta patología con TENMO. Sin embargo, el paciente tuvo una presentación aislada de SAF sin otros hallazgos clínicos y de imagen que cumplieron con los criterios del consenso internacional de TENMO (10).
, lo que asocia esta patología con TENMO. Sin embargo, el paciente tuvo una presentación aislada de SAF sin otros hallazgos clínicos y de imagen que cumplieron con los criterios del consenso internacional de TENMO (10).
Conclusión:
Presentamos el caso de una recidiva de LES que debuta con vómitos incoercibles secundarios a un síndrome del área postrema. Se trata de una manifestación neuropsiquiátrica atípica del lupus, cuyo principal diferencial es TENMO, pero cuya diferencia es la positividad superior al 80% en esta última patología en los anticuerpos IgG anti acuaporina 4.
Referencias:
1) Camara-Lemarroy, C. R., & Burton, J. M. (2018). Area postrema syndrome: A short history of a pearl in demyelinating diseases. Multiple Sclerosis Journal,
2) De Souza, T. F. S. (2020). A concise historical perspective of the area postrema structure and function. Archivos de neuro-psiquiatría, 78, 121-123.
3) Shosha, E., Dubey, D., Palace, J., Nakashima, I., Jacob, A., Fujihara, K., ... & Pittock, S. J. (2018). Area postrema syndrome: Frequency, criteria, and severity in AQP4-IgG–positive NMOSD. Neurology, 91(17), e1642-e1651.
4) Hanly, J. G., & Inanç, M. (2021). The neurology of lupus. Journal of the Neurological Sciences, 424.
5) Díaz-Cortés D., Correa-González N.,Díaz MC., Gutiérrez JM., Fernández-Ávila D., Compromiso del sistema nervioso central en el lupus eritematoso sistémico, Revista Colombiana de Reumatología, Volume 22, Issue 1, 2015.
6) Beltrán, A., Goyes, A. B., Mora, C., Arrieta, K., & Jaramillo, E. A. (2019). Prevalence of neurolupus in a Colombian cohort. Revista Colombiana de Reumatología, 26(3), 160-164.
7) Vassallo, J. (2019). Area postrema syndrome secondary to lupus neuroinflammation. Journal of Pediatric Ophthalmology & Strabismus, 56(5), 340-340.
 De Medeiros, C. L., Lessa, V. C., Prata, M. R., de Lemos, R. P., Monfredinho, A. R., de Freitas, G. R., & Braune, C. B. (2021). Neuromyelitis optica spectrum disorders and systemic lupus erythematosus: A case series from a university center. Revue Neurologique.
De Medeiros, C. L., Lessa, V. C., Prata, M. R., de Lemos, R. P., Monfredinho, A. R., de Freitas, G. R., & Braune, C. B. (2021). Neuromyelitis optica spectrum disorders and systemic lupus erythematosus: A case series from a university center. Revue Neurologique.
9) Sarwar S, Mohamed AS, Rogers S, Sarmast ST, Kataria S, Mohamed KH, Khalid MZ, Saeeduddin MO, Shiza ST, Ahmad S, Awais A, Singh R. Neuropsychiatric Systemic Lupus Erythematosus: A 2021 Update on Diagnosis, Management, and Current Challenges. Cureus. 2021 Sep 14;13(9):e17969.
10) Dutra B., Da Rocha A., Hoffmann-Nunes R., Martins-Maia Júnior A. Neuromyelitis Optica Spectrum Disorders: Spectrum of MR Imaging Findings and Their Differential Diagnosis. RadioGraphics 2018 38:1, 169-193.
Tabla 1. Resultados de laboratorio durante la hospitalización.
Imagenes:
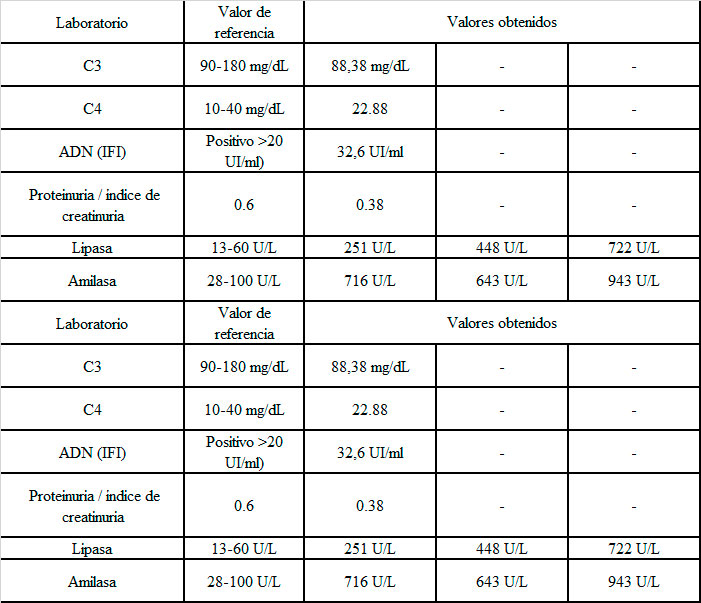
Imagen 1. A) RM del cerebro en corte sagital, en secuencia T1, donde no se observa hallazgo patológico evidente. B y C) RM del cerebro en plano axial en secuencias T2 y FLAIR, donde una lesión hiperintensa concéntrica se observa en el área postrema.
Imagen 1. D y E) RM del cerebro en plano axial, en secuencia T1, TRACE y ADC donde no se observa restricción a la difusión. F) RM del cerebro en el plano axial, secuencia T1 post contraste donde no se observa realce de la lesión descrita.
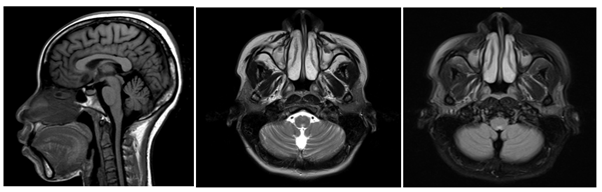
Imagen 2. A) RM del cerebro en corte sagital, en secuencia T2 donde se aprecia que la lesión hiperintensa persiste en el área postrema. B) RM del cerebro en corte axial en secuencia T1 posterior a administración de medio de contraste donde se observa un realce puntiforme en el área postrema.
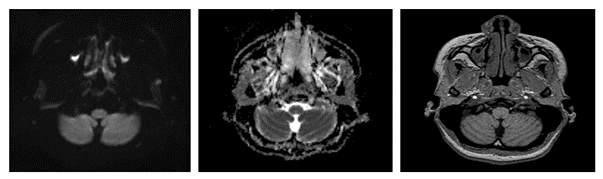
Imágen 3 y 4. RM de columna cervical y torácica en plano sagital en secuencia T2 donde la ausencia de la lesión se demuestra.
Muñoz-Zuñiga Jose Ricardo1, Tamayo-Delgado Andrea del Mar2, Shinchi-Tanaka Alberto Masaru 3, Márquez Juan Camilo 4 Echeverry-García Alex 5,6
(1) Residente de Neurología; Universidad Icesi, Cali, Colombia;
(2) Residente de Radiología e imágenes diagnósticas; Universidad Icesi, Cali, Colombia;
(3) Servicio de Neurología, Fundación Valle del Lili, Cali, Colombia
(4) Servicio de Radiología, Fundación Valle del Lili, Cali, Colombia;
(5) Servicio de Reumatología y enfermedades autoinmunes sistémicas, Fundación Valle del Lili, Cali, Colombia;
(6) Centro de investigación en reumatología, autoinmunidad y medicina traslacional, Universidad Icesi.
Autor de correspondenciar:
Jose Ricardo Muñoz Zuñiga
Email: Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
Abstract:
Postrema area syndrome (PAS) is commonly associated with neuromyelitis optic spectrum disorders (NMOSD). We present a case of a 27-year-old woman, with a history of systemic lupus erythematosus (SLE) with multiple manifestations, that developed incoercible emesis associated with abdominal pain and a single episode of altered consciousness. During her work up magnetic resonance imaging showed a punctiform hyperintensity in the postrema area without other findings in the neuroaxis. Her anti-aquaporin 4 antibodies were negative. It was considered a diagnosis of PAS secondary to SLE relapse. This association is infrequent and there is little bibliography so it could represent a diagnostic challenge.
Key words: Area Postrema, Systemic Lupus Erythematosus, Vomit
Resumen:
El síndrome del área postrema (SAP) está asociado con los trastornos del espectro de neuromielitis óptica principalmente (TENMO). Presentamos un caso de una mujer de 27 años, con antecedente de Lupus eritematoso sistémico (LES), con compromiso multisistémico que consultó por cuadro de emesis incoercible asociado a dolor abdominal y un único episodio de alteración de la consciencia. Durante sus estudios complementarios la imagen de resonancia magnética mostró una hiperintensidad puntiforme en el área postrema sin otros hallazgos en el neuroeje. Sus anticuerpos anti-acuaporina 4 fueron negativos. Se consideró diagnóstico de SAP secundario a una recaída de LES. Esta asociación es infrecuente y hay poca bibliografía al respecto, por lo que puede representar un reto diagnóstico.
Palabras clave: Área Postrema, Lupus Eritematoso Sistémico, Vómito.
Introducción:
Las náuseas y vómito son causados por múltiples etiologías. Neurobiológicamente, están controlados por varias estructuras centrales ubicadas en el tronco encefálico. Una de estas estructuras es el área postrema (AP), que sirve como la zona quimiorreceptora que desencadena emesis (1).
La AP fue descrita por primera vez en 1896 por el neuroanatomista sueco Magnus Gustaf Retzius en su libro "El cerebro humano. Estudios de morfología macroscópica" (2) de la siguiente manera: "estructura esponjosa localizada en el tronco encefálico, cerca del agujero de Magendie". Pero no fue hasta principios del siglo pasado (1920) cuando se determinaron la estructura y la función (1). Se localiza en el rombencéfalo, situada en el cuarto ventrículo, en la superficie dorsal de la médula adyacente al núcleo del tracto solitario. Es un verdadero núcleo del bulbo, forma parte de los órganos circumventriculares, carece de barrera hematoencefálica y consiste en una red vascular densa y ramificada con sinusoides vasculares, fenestras múltiples y ausencia de uniones estrechas. Estas características le permiten detectar elementos en la sangre y el líquido cefalorraquídeo, funcionando como un regulador osmótico e inmunomodulador. Además, funciona como un quimiorreceptor que media el hipo y la emesis (3) (4).
El daño en esta ubicación configura el síndrome del área postrema (SAP), que se define como ataques incoercibles de náuseas, vómitos o hipo en el contexto de una lesión dorsal en el tronco encefálico. Los trastornos del espectro de neuromielitis óptica (TENMO) generalmente se considera como la primera etiología, ya que el daño a este objetivo es parte de los criterios diagnósticos para estos diagnósticos (4). Sin embargo, la asociación con otras enfermedades autoinmunes es rara. Presentamos el caso de un paciente con antecedentes de LES que, en el contexto de una recidiva de la enfermedad, desarrolló un SAP de probable origen inflamatorio como manifestación atípica, y revisamos la literatura disponible sobre el tema.
Caso clínico:
Paciente del sexo femenino de 27 años ingresada en nuestra institución por un cuadro clínico de 10 días de evolución consistente en episodios repetidos de emesis, de contenido alimenticio y bilioso, asociado a dolor localizado en el epigastrio y disfagia para alimentos sólidos y líquidos. Tenía antecedentes de LES, con afectación en múltiples sistemas (Osteoarticular, hematológico, renal e inmunológico), con controles médicos regulares en los últimos meses y estaba siendo tratada con azatioprina 50 mg cada 12 horas, cloroquina 250 mg cada 24 horas y losartan 50 mg cada 24 horas. En el examen físico tenía signos de deshidratación leve y sin signos peritoneales irritativos. Los laboratorios iniciales mostraron lipasa sérica y amilasa elevados, fragmento del complemento C3 consumido y anticuerpo antiADN elevado (ver Tabla 1 para valores y referencias). Los estudios de imagen consistieron en tomografía abdominal contrastada, ecografía abdominal y endoscopia, todas negativas. Dada la persistencia de los síntomas, se realizó un diagnóstico de pancreatitis aguda leve con LES recidivante y se proporcionó tratamiento intrahospitalario sintomático, sin mejoría.
Debido a la evolución tórpida de la paciente, su familia fue interrogada sobre el estado de la paciente, a lo que el familiar agregó síntomas adicionales consistentes en episodios de accesos de tos con posterior alteración de la conciencia y movimientos anormales en las extremidades compatibles con crisis epiléptica tónica clónica bilateral con amnesia del evento. Se sospechó una etiología en el sistema nervioso central por lo que, posteriormente, se solicitó una resonancia magnética contrastada del cerebro; esta reportó una lesión única hiperintensa en la secuencia T2 en el área postrema; por lo tanto, se enfocó como un posible SAP (Imagen 1). Para descartar posibles etiologías se realizó una punción lumbar que informó presión de apertura de 26 cmH2O, 1 linfocito, glucosa 56mg/dL, proteínas 26 mg/dL; Gram/Tinta china/Panel molecular para meningitis fueron negativos. Además, los cultivos para bacterias, hongos, micobacterias, PCR-RT para tuberculosis y bandas oligoclonales fueron todos negativos. Dado lo anterior, se decidió cambiar el esteroide de prednisolona a hidrocortisona 100 mg cada 8 horas. La paciente mejoró significativamente después de este ajuste hasta el punto en que sus síntomas cesaron, y pudo ser dada de alta con una fórmula médica.
Una semana más reingresó a por servicio de urgencias debido a una exacerbación aguda del dolor abdominal previo y emesis. Se realizaron nuevos estudios de imagen complementarios: la colangiopancreatografía por resonancia magnética fue negativa, descartando enfermedades de la vesícula biliar y una nueva resonancia magnética contrastada del cerebro y la columna cérvico- descartó mielopatía en la columna vertebral, pero mostró un aumento considerable en la extensión del área de la lesión postrema con un notorio realce con gadolinio (Imagen 2). Se indicó un pulso de metilprednisolona de 1 gramo durante 3 días, se realizó una reinducción de ciclofosfamida; recibió un total de 2 dosis durante su hospitalización. Fue dada de alta nuevamente con mejoría clínica con una orden de continuar con ciclofosfamida, medicación previa y una orden para un perfil complementario de síndrome de antifosfolípidos y anticuerpos anti-acuaporina 4. En un control ambulatorio posterior, el paciente no refirió nuevas recaídas y mostró una IgM anticardiolipina positiva e IgM positiva para la glicoproteína beta 2 I con anticuerpos anti-acuaporina 4 negativos. Se añadió una dosis baja de inhibidores de la agregación plaquetaria y se realizó un diagnóstico altamente probable de SAF secundario a LES.
Discusión:
El LES es una enfermedad autoinmune que puede comprometer cualquier órgano. El compromiso neurológico es una de las principales causas de morbilidad y mortalidad en estos pacientes (5). El término LES neuropsiquiátrico (LESNP) es un término genérico que se refiere a varios síntomas neurológicos y psiquiátricos directamente relacionados con el LES. En aproximadamente el 30% de los pacientes con síntomas neuropsiquiátricos, el lupus es la causa principal y los síntomas se manifiestan con mayor frecuencia alrededor del inicio de la enfermedad. Las afecciones neurovasculares y psicóticas también pueden conducir a LESNP (10).
Dentro del espectro clínico del LES, la afectación del sistema nervioso representa el mayor reto diagnóstico y terapéutico, ya que engloba una numerosa variedad de manifestaciones neurológicas que varían en su presentación desde focales a difusas, centrales, periféricas, aisladas, complejas, leves o severe y que pueden ocurrir en cualquier momento de la enfermedad (5).
La prevalencia del LESNP es del 12 al 95% de los cuales tienen una afectación del sistema nervioso central del 93,1-95% (4,5) y el síndrome desmielinizante ocurre entre el 0,9 y el 2,7% de los casos (4). En Colombia, las manifestaciones más frecuentes de LESNP son cefalea (13,1%) y enfermedad cerebrovascular (8%); solo 0,4% presentó síndrome desmielinizante, por lo que incluso para los estándares nacionales es una presentación muy rara. Según el conocimiento de los autores, este sería el tercer caso de SAP secundario al LES (7).
Fisiopatológicamente, se considera que estas manifestaciones están mediadas por una combinación no exclusiva de lesión isquémica e inflamación. En el primer caso, la acción de los antifosfolípidos anticuerpos, los complejos inmunes y la activación del complemento podrían causar eventos focales con manifestaciones neuropsiquiátricas difusas. En el segundo caso, participa el aumento de la permeabilidad de la barrera hematoencefálica, la unión de autoanticuerpos a las neuronas, la formación intratecal de complejos inmunes y la producción de mediadores inflamatorios (5)(6).
El principal diagnóstico diferencial es TENMO (4). Vale la pena mencionar que las lesiones del área postrema no son específicas de estos trastornos (4); hay evidencia de coexistencia con enfermedades autoinmunes seropositivas como artritis reumatoide, sarcoidosis, síndrome de Sjögren y LES (6). Este espectro de trastornos presenta afectación variada del sistema nervioso central (nervios ópticos, médula espinal, diencéfalo, tronco encefálico y lluvia). La alta especificidad de AQP4-IgG ha permitido el reconocimiento de un espectro más amplio de características clínicas y radiológicas relacionadas con TENMO (4). Se ha demostrado la positividad de anticuerpos anti-AQP4 positivos en el LES (
Conclusión:
Presentamos el caso de una recidiva de LES que debuta con vómitos incoercibles secundarios a un síndrome del área postrema. Se trata de una manifestación neuropsiquiátrica atípica del lupus, cuyo principal diferencial es TENMO, pero cuya diferencia es la positividad superior al 80% en esta última patología en los anticuerpos IgG anti acuaporina 4.
Referencias:
1) Camara-Lemarroy, C. R., & Burton, J. M. (2018). Area postrema syndrome: A short history of a pearl in demyelinating diseases. Multiple Sclerosis Journal,
2) De Souza, T. F. S. (2020). A concise historical perspective of the area postrema structure and function. Archivos de neuro-psiquiatría, 78, 121-123.
3) Shosha, E., Dubey, D., Palace, J., Nakashima, I., Jacob, A., Fujihara, K., ... & Pittock, S. J. (2018). Area postrema syndrome: Frequency, criteria, and severity in AQP4-IgG–positive NMOSD. Neurology, 91(17), e1642-e1651.
4) Hanly, J. G., & Inanç, M. (2021). The neurology of lupus. Journal of the Neurological Sciences, 424.
5) Díaz-Cortés D., Correa-González N.,Díaz MC., Gutiérrez JM., Fernández-Ávila D., Compromiso del sistema nervioso central en el lupus eritematoso sistémico, Revista Colombiana de Reumatología, Volume 22, Issue 1, 2015.
6) Beltrán, A., Goyes, A. B., Mora, C., Arrieta, K., & Jaramillo, E. A. (2019). Prevalence of neurolupus in a Colombian cohort. Revista Colombiana de Reumatología, 26(3), 160-164.
7) Vassallo, J. (2019). Area postrema syndrome secondary to lupus neuroinflammation. Journal of Pediatric Ophthalmology & Strabismus, 56(5), 340-340.
9) Sarwar S, Mohamed AS, Rogers S, Sarmast ST, Kataria S, Mohamed KH, Khalid MZ, Saeeduddin MO, Shiza ST, Ahmad S, Awais A, Singh R. Neuropsychiatric Systemic Lupus Erythematosus: A 2021 Update on Diagnosis, Management, and Current Challenges. Cureus. 2021 Sep 14;13(9):e17969.
10) Dutra B., Da Rocha A., Hoffmann-Nunes R., Martins-Maia Júnior A. Neuromyelitis Optica Spectrum Disorders: Spectrum of MR Imaging Findings and Their Differential Diagnosis. RadioGraphics 2018 38:1, 169-193.
Tabla 1. Resultados de laboratorio durante la hospitalización.
Imagenes:
Imagen 1. A) RM del cerebro en corte sagital, en secuencia T1, donde no se observa hallazgo patológico evidente. B y C) RM del cerebro en plano axial en secuencias T2 y FLAIR, donde una lesión hiperintensa concéntrica se observa en el área postrema.
Imagen 1. D y E) RM del cerebro en plano axial, en secuencia T1, TRACE y ADC donde no se observa restricción a la difusión. F) RM del cerebro en el plano axial, secuencia T1 post contraste donde no se observa realce de la lesión descrita.
Imagen 2. A) RM del cerebro en corte sagital, en secuencia T2 donde se aprecia que la lesión hiperintensa persiste en el área postrema. B) RM del cerebro en corte axial en secuencia T1 posterior a administración de medio de contraste donde se observa un realce puntiforme en el área postrema.
Imágen 3 y 4. RM de columna cervical y torácica en plano sagital en secuencia T2 donde la ausencia de la lesión se demuestra.
Adjuntos:
El siguiente usuario dijo gracias: Diana Judith Bravo Guzman
Por favor, Identificarse para unirse a la conversación.
Moderadores: Jorge Mario Gaspar Toro, Juan Pablo Ovalle Rojas